化学平衡产率计算公式
阅读文章前辛苦您点下“关注”,方便讨论和分享,为了回馈您的支持,我将每日更新优质内容。

文 |史记新说
编辑 | 史记新说
简介
众所周知,石油是全世界燃料能源的平均来源,并且至少要持续几十年。作为减少环境污染的一种手段,与广泛采用的硫和氮法规相吻合,从中间馏分燃料中去除硫化合物非常重要,通常使用加氢脱硫(HDS)。
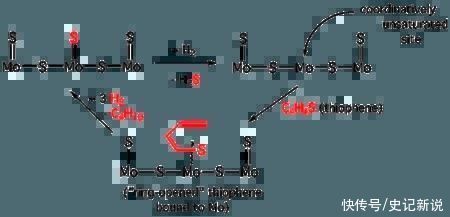
然而,多环芳烃硫物种构成了该燃料中含硫化合物的主要部分,并且很难通过这种催化过程完全降解。在HDS过程中,催化剂的活性受到各种反应基质的影响,H2已知S通过抑制C-S键的氢解来大大减慢反应速率。
然而,在这样的条件下,硫底物物种必须在H2S.许多基于固定床系统或间歇式反应器的研究都报告了在存在H2S 。
这种行为在这一研究领域是众所周知的,其中共识催化剂由于H2S.活性降低的程度多种多样,并且高度依赖于催化剂的特性,其中硫底物的建立反应网络很重要。
然而,最近报道了关于二苯并噻吩(DBT)和4,6-二甲基二苯并噻吩的HDS的有趣结果,这表明H2S 实际上可能会促进某些 MoS 的 HDS 活性2类催化剂。
据我们所知,这样的结果很有趣,但令人惊讶的是,缺乏关于跟踪和广泛调查这一点的文献。
因此,需要彻底描述这种方法的动力学建模。总体催化活性和选择性似乎取决于H2S在反应介质中。
总体而言,从迄今为止的结果中可以明显看出,H2S以某种方式改变了该反应中活性位点的化学性质。
研究H2为了确定吸附平衡常数,本工作结合MoS进行了多次DBT HDS实验2催化剂在各种条件下,并推导出详细的动力学模型,以帮助了解反应机理。
结果和讨论
DBT的HDS检测出的主要产物是联苯(BP),环己基苯(CB),部分氢化DBT(HDBT)和H2S.如前所述,各种 H2在HDS反应过程中使用S浓度,图1和图2总结了DBT的HDS过程中从氢化(HYD)和直接脱硫(DDS)反应中获得的中间产物。
这些产品的形成取决于H是否2原位生成的S从反应混合物中除去或保留在反应混合物中。具体而言,在存在H2S,而DDS产品减少。从图2可以看出HYD路由产品的非线性特性。
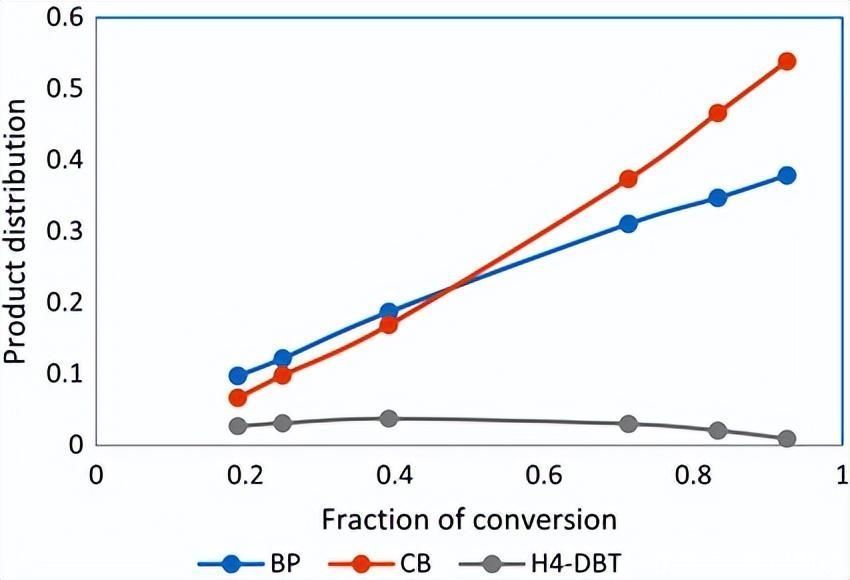
图1.DBT在HDS期间的产品分布,没有H2S.
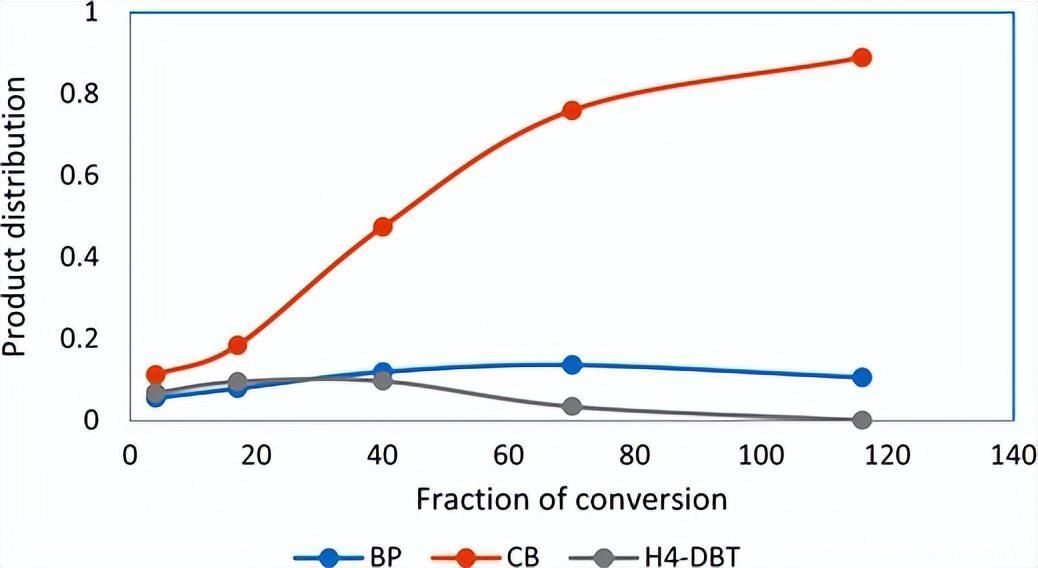
图2.在存在 H 的情况下,DBT 的 HDS 期间的产品分布2S.
动力学
动力学计算中涉及几个假设和简化。首先,假设DBT的HDS主要由DDS和HYD进行,如方案1所示。
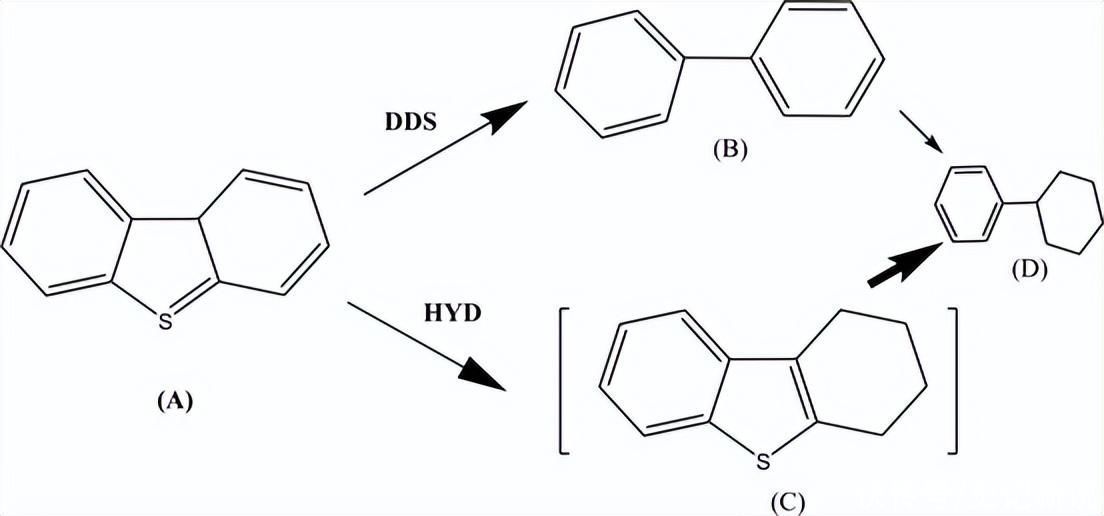
方案 1.DBT的HDS反应过程中形成的中间产物。
此外,假设CB主要由部分氢化的DBT产生,因此该产物的形成将由H2S,与先前的报告一致。H 的影响2对反应速率的压力被忽略了,因为H2被添加过量,因此可以包含在内在速率常数中。
根据方程式考虑了两个活性位点,一个用于HYD,另一个用于DDS(所有符号和参数在符号部分或文本中标识):

在这种情况下,加氢位点的浓度(πH) 将受到 H 存在的影响2S同时浓度σD网站几乎不受影响。考虑了两种情况,包括DBT的HDS反应,有和没有H2S.
先前的一些研究表明,DBT的HDS是伪零阶反应,而其他人则确定这是伪一级反应。如下所述,本研究的结果与后一种行为一致,因此本文的分析基于伪一级动力学。
基于反应组分的质量平衡,调整速率方程以定量描述产物分布。这些方程(其详细信息已发表)是:
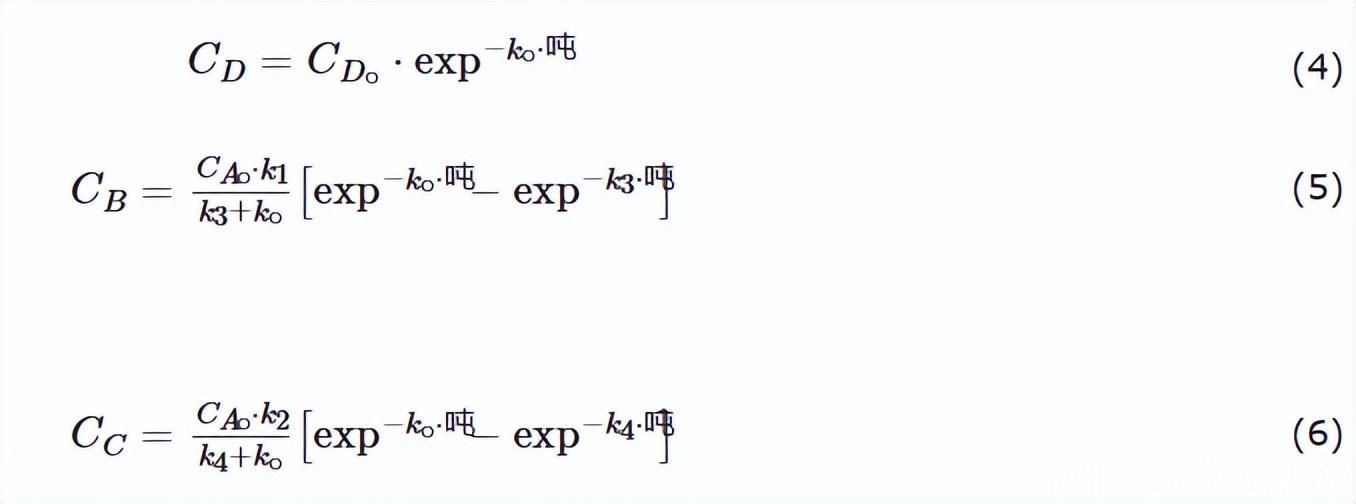
无H时的反应速率2S在公式(4)中用伪一阶关系很好地表示,数据图如图3所示。在这里,实验点与该方程的拟合由高回归因子证实。
使用公式(5)和(6)拟合反应中间体的实验结果,这只需要对两个变量(k1和 k2).每个数据拟合都使用 Mathcad 软件包执行,并通过顺序迭代采用非线性方法,直到收敛。
图4绘制了中间物质的浓度与反应时间的关系图,还显示了使用方程(5)和(6)获得的拟合,这些拟合证实了模型的有效性。
将实验数据与模型拟合可以确定速率常数,从而能够估计中间体B和C对HDS反应过程中D的产率。
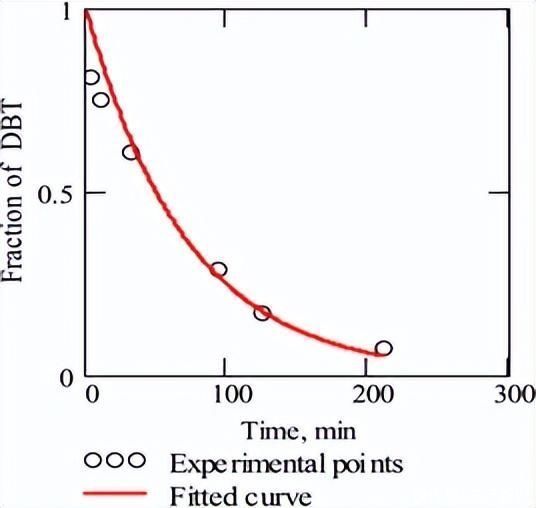
图3.在没有 H 的情况下,在 HDS 的 DBT 期间获取的数据的伪一阶图2S 在 340°C 和 3 MPa H2.
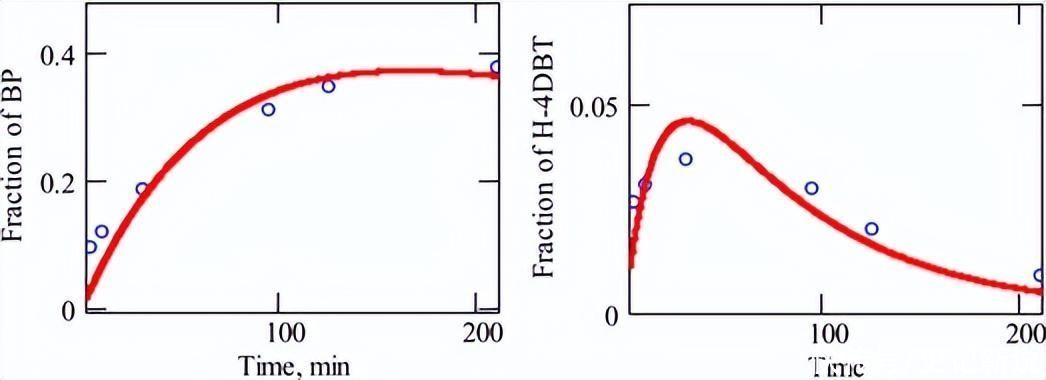
图4.在没有 H 的情况下,DBT 的 HDS 期间生成 BP 和 H4-DBT 的实验数据和拟合2S.
HDS反应过程中D的产率。在给定时间t转换为D的B或C的分数由以下公式估计:
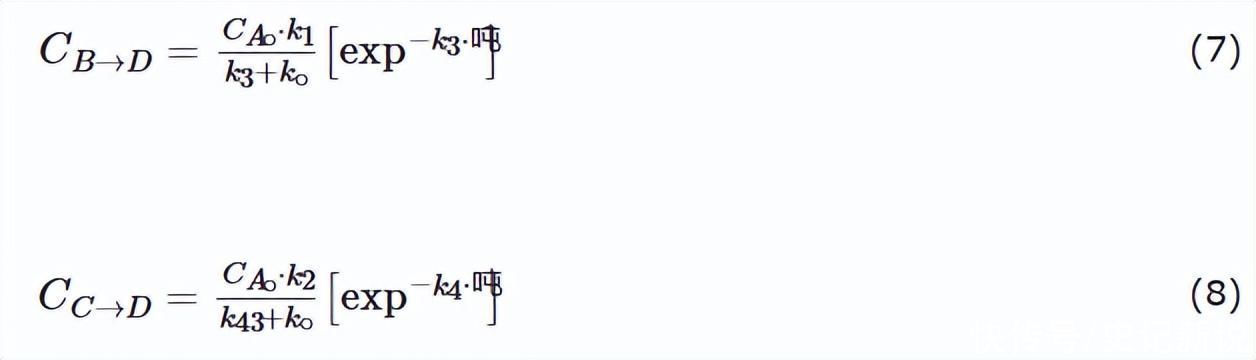
以这种方式测定的表观动力学参数见表1。这项工作中使用的模型基于Langmuir-Hinshelwood机制的一个版本,因此HYD和DDS反应的速率方程为:

通过代入,可以得到以下方程:

一旦找到单个表观速率常数,就可以比较平衡吸附常数。实验数据根据公式(11)-(13)拟合,如图5所示。
使用从先前计算中确定的平行反应的表观速率常数,预测了底物在σ位点和π位点上的吸附平衡常数,值如表2所示。
有关产品分布的数据是验证的主要手段
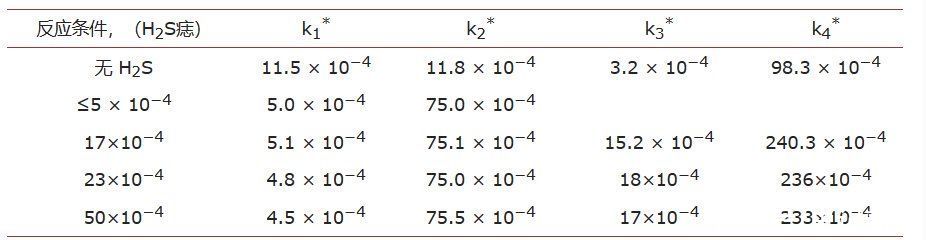
表 1.不同 H 下 DBT 的 HDS 动力学参数2S浓度。
*个别表观速率常数,不确定度约为 3% - 5%。
在本例中观察到任何动力学模型和典型的可逆行为,无论有无H2S.这是通过实验试验确定的,在此期间使用不同浓度的H2S.在这些条件下,H2S被确定为涉及物理可逆过程,并且与催化剂的性质有关。
在现有的H2S,加氢反应产物占主导地位,从图4和图6的比较可以看出,因此该路线的活性明显提高。H 的影响2S可以用其在反应原料中的浓度来讨论。由于反应是在间歇系统中进行的,因此对自催化类动力学的经典处理得出了以下方程:
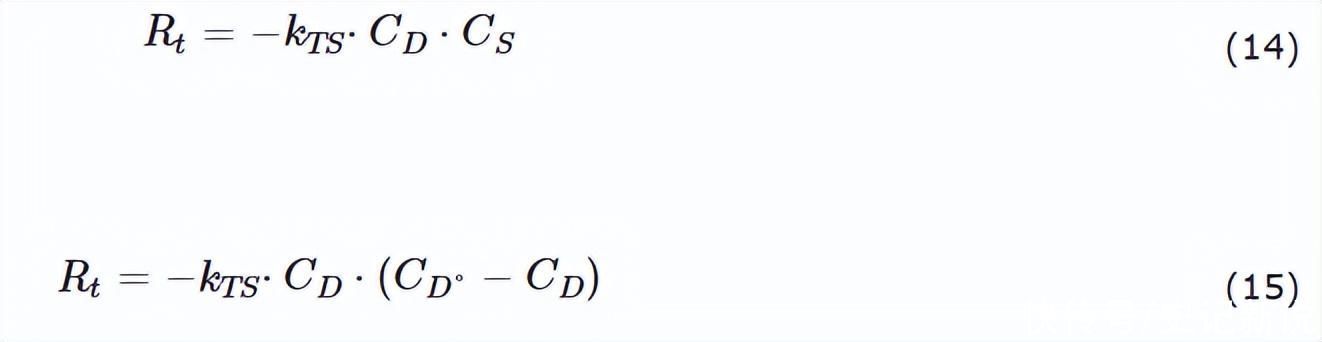
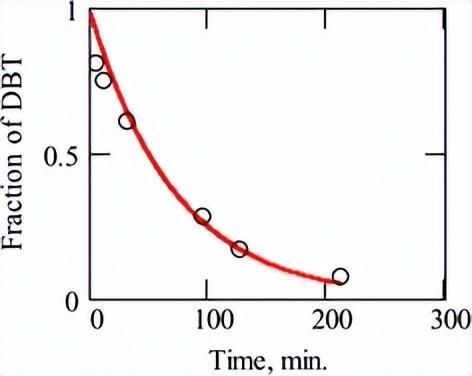
图5.在没有H的情况下,DBT的HDS期间获得的实验数据2公式 (13) 中基于朗缪尔-欣谢尔伍德关系的 S 和管接头。
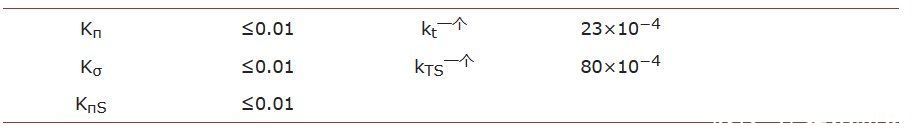
表 2.平衡吸附常数和动力学系数由DBT的HDS期间获取的数据的模型拟合确定。
答:S−1∙gcat−1.
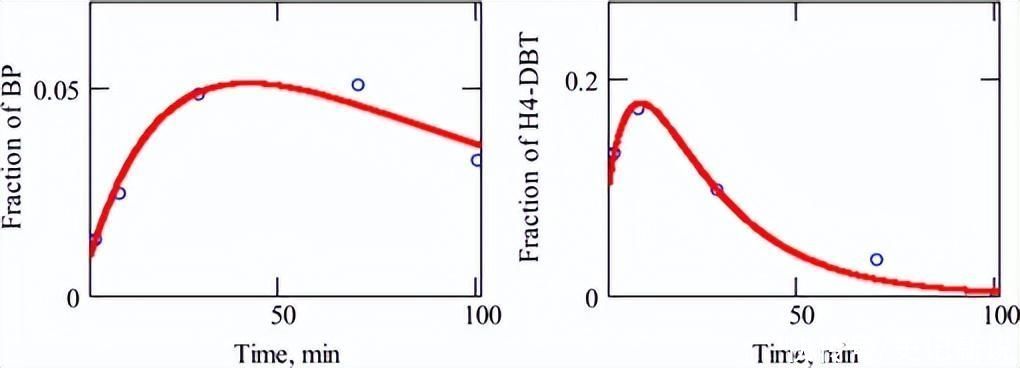
图6.在存在 4 × 17 的情况下,DBT 的 HDS 期间产生 BP 和 H10-DBT 的实验数据−4痣H2S.
在这里,Rt是总反应速率和 kTS是此条件下的总体速率常数。在本试验中,DBT和H的摩尔总和2S 在任何给定时间保持不变,因此我们可以这样写:
积分后,公式(15)可以重新排列为:
图7描述了根据该等式的实验数据,并展示了合适的线性回归。基于朗缪尔-欣谢尔伍德机制,如果 H2原位生成的S保留在反应介质中,我们可以写出速率(RH-S) 如下:
在重新排列和替换后,它变成:

DDS 路由不被认为受 H 存在的影响2S,所以我们有:
这表明反应速率表现出类似自催化行为的特殊情况。在自催化过程中,催化机理中涉及反应产物之一,因此应包含在速率定律中。
在当前 MoS 的 HDS 期间2催化剂,发现反应速率由H2S,因此该物种可能影响活性催化位点的潜力和性质。因此,在H2原位生成的 S,RTS,可以表示为:
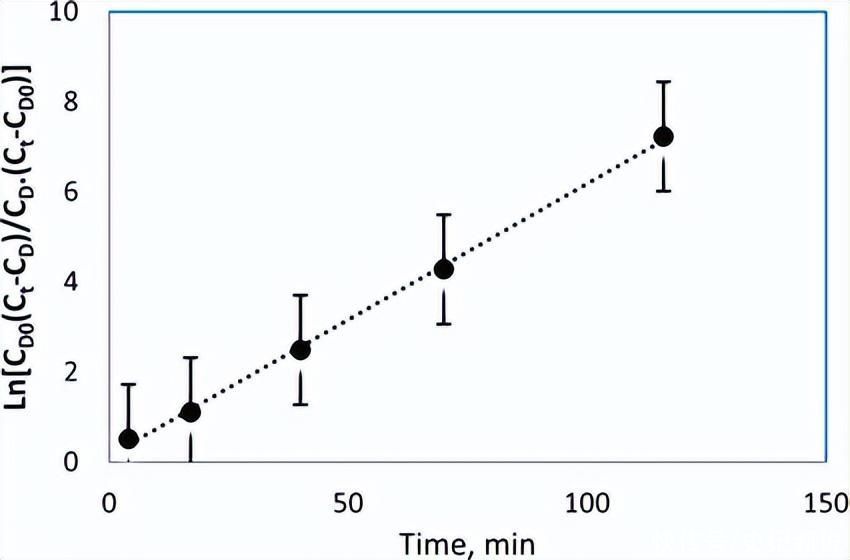
图7.基于公式(17)确认DBT的HDS自催化性质的线性图。
其中 RTS是总体反应速率。与公式(21)相关的相关性如图8所示,并显示了与实验数据的合适拟合。基于经典处理和使用方程(19)-(21)的数据分析估计的常数,与H2S可以确定,这种计算的结果在表2中提供。
在模型仿真中,由于模型中使用的常数数量有限,因此要采用的模型的有效性增加。为了尽量减少动力学模型中包含的常数数量,我们首先根据方程(5)和(6)的模型计算反应参数,然后估计参与反应的每个中间产物的比例,然后根据促进模型再次操纵动力学处理。
通过这些计算,发现π位点的DBT吸附平衡常数与σ位点的DBT吸附平衡常数之比接近统一。因此,当使用本催化剂时,反应物在任一活性位点上均未优先吸附。
应该注意的是,吸附平衡常数估计具有这个极限值Kσ或 Kπ≤0.01和K的比率π/Kσ≈ 1.基于先前关于HDS反应的研究和本研究中估计的动力学参数,可以分析如下实验数据。
当在没有H的情况下进行HDS反应时2S,数据可以与我们小组最近开发的模型拟合,其中所有反应产物都包含在速率方程中(即方程(4)-(6))。
该模型随后用于模拟图4所示的实验数据,可以看出实验值与模拟之间的合理一致性。该模型预测的估计值如表1所示。如果HDS过程作为伪一级反应进行,则模型可能适用。
图8.在存在H的情况下DBT的HDS期间获得的实验数据2S,拟合基于公式(21)。
如果 H2原位生成的S残留在反应混合物中,得到对应于自催化行为的动力学速率曲线,如图7和图8所示。在这种情况下,应用基于方程(17)和(21)的模型来模拟整个反应的实验数据,这些预测与实验值所表现出的趋势相匹配。
在应用该模型时,应主要考虑底物在两个活性位点上吸附的平衡常数及其比率。
此外,在拟合在存在H2S.因此,在没有H2S用于评估存在H2S. 包括此类限制可能有助于改进仿真结果。结果清楚地表明,DBT和H几乎没有变化。2S吸附平衡常数和这些常数的值保持在≤0.01。
存在过量的 H2S,该物种的一部分改变了潜在的活性位点,而其余的基本上不参与反应。这种情况与实际炼油厂执行HDS的情况非常相似。
催化剂可以以动力学上与第一阶段部分相似的方式参与反应。上面讨论的与第一阶段相关的模型也可用于描述该反应,相关的动力学数据列于表1中。
有趣的是,H2S在第一次给药后具有效果,使得反应进行得好像H2S进行自我推销。此后,随着 H2S浓度在原料中,其主要作用几乎保持不变,反应在动力学上表现为伪一级过程。
这种效应可能归因于H产生的新活性位点的形成2S.达到平衡后,此时H2S已经修饰了所有可能的潜在活性位点,反应通过两种活性位点的参与正常进行。
因此,H诱导的自我促进效应2S基本上是暂时的,与活性位点的修饰直至饱和有关。需要注意的另一点是,过量的 H2S既不诱导催化活性的进一步促进,也不抑制催化活性。
这些结果强调H2S可能通过提高活性位点的效率,增加位点的数量或两者兼而有之来充当启动子。
结论
基于假设在 MoS 上 DBT 的 HDS 期间 DDS 和 HYD 的两个不同活性位点的动力学模型2构建了催化剂,与实验结果吻合较好。根据这些模型,H2S通过其化学参与反应机理促进HYD,而H2产生两个不同的活性位点:一个用于HYD,另一个用于DDS。
H 的存在2S可能导致新的和高效的HYD活性位点的形成。由于可以通过 H 激活的活性位点数量固定2或 H2S,在评估选择性时,重要的是要将新创建的站点的数量视为站点总数的比率。
因此,随着HYD活性位点(π*)数量的增加,DDS活性位点(σ)的数量减少。总体而言,这项研究表明,两种反应机制是可能的,这取决于H是否2S存在于反应介质中。可以推断,HDS反应可以通过包括最佳H2S浓度在反应原料中以产生更多的活性位点。
","gnid":"95158e9ad5303a0d5","img_data":[{"flag":2,"img":[{"desc":"","height":"121","title":"","url":"https://p0.ssl.img.360kuai.com/t0105c12b150cb3e03d.jpg","width":"767"},{"desc":"","height":"320","title":"","url":"https://p0.ssl.img.360kuai.com/t01cf1a18a8805b4230.jpg","width":"562"},{"desc":"","height":"940","title":"","url":"https://p0.ssl.img.360kuai.com/t0157d329aec4f72d77.jpg","width":"1094"},{"desc":"","height":"217","title":"","url":"https://p0.ssl.img.360kuai.com/t01ce11468b05a0472a.jpg","width":"450"},{"desc":"","height":"580","title":"","url":"https://p0.ssl.img.360kuai.com/t014e2967657a02f1bd.jpg","width":"850"},{"desc":"","height":"568","title":"","url":"https://p0.ssl.img.360kuai.com/t011e20f7e49c171624.jpg","width":"1038"},{"desc":"","height":"516","title":"","url":"https://p0.ssl.img.360kuai.com/t01cc5aea41d04d133e.jpg","width":"1104"},{"desc":"","height":"98","title":"","url":"https://p0.ssl.img.360kuai.com/t01c060c736b860f98c.jpg","width":"623"},{"desc":"","height":"504","title":"","url":"https://p0.ssl.img.360kuai.com/t013b594ef7f09eb8c1.jpg","width":"1356"},{"desc":"","height":"508","title":"","url":"https://p0.ssl.img.360kuai.com/t01ee72890ba9d373c8.jpg","width":"536"},{"desc":"","height":"380","title":"","url":"https://p0.ssl.img.360kuai.com/t0132558c113e4c5560.jpg","width":"1046"},{"desc":"","height":"360","title":"","url":"https://p0.ssl.img.360kuai.com/t01d9b1b6ca62bfaf6e.jpg","width":"1256"},{"desc":"","height":"344","title":"","url":"https://p0.ssl.img.360kuai.com/t01f74c7405376e6193.jpg","width":"1174"},{"desc":"","height":"462","title":"","url":"https://p0.ssl.img.360kuai.com/t0115d811ed0a236641.jpg","width":"1186"},{"desc":"","height":"240","title":"","url":"https://p0.ssl.img.360kuai.com/t01199e803294a022fc.jpg","width":"926"},{"desc":"","height":"342","title":"","url":"https://p0.ssl.img.360kuai.com/t01d4740377018c65d1.jpg","width":"1322"},{"desc":"","height":"376","title":"","url":"https://p0.ssl.img.360kuai.com/t0120e50d653bc21510.jpg","width":"472"},{"desc":"","height":"132","title":"","url":"https://p0.ssl.img.360kuai.com/t018d4e8d94bdd34e7a.jpg","width":"915"},{"desc":"","height":"368","title":"","url":"https://p0.ssl.img.360kuai.com/t01838facf0f8b33d03.jpg","width":"1020"},{"desc":"","height":"71","title":"","url":"https://p0.ssl.img.360kuai.com/t01c485c42ffd1e51ac.jpg","width":"642"},{"desc":"","height":"560","title":"","url":"https://p0.ssl.img.360kuai.com/t018b4f83ae134e236b.jpg","width":"850"},{"desc":"","height":"177","title":"","url":"https://p0.ssl.img.360kuai.com/t01133b55276d63de05.jpg","width":"500"},{"desc":"","height":"424","title":"","url":"https://p0.ssl.img.360kuai.com/t01a9b6435d9a0dda5f.jpg","width":"530"},{"desc":"","height":"500","title":"","url":"https://p0.ssl.img.360kuai.com/t01b8bf251f2faf4a69.jpg","width":"719"}]}],"original":0,"pat":"art_src_3,fts0,sts0","powerby":"pika","pub_time":1690363620000,"pure":"","rawurl":"http://zm.news.so.com/1b62a5aafdd2c3c3bcefef136d9231a2","redirect":0,"rptid":"97c2ba3eb8b0192f","rss_ext":[],"s":"t","src":"史记新说","tag":[],"title":"H影响的动力学建模2纳米MoS间歇系统中二苯并噻吩加氢脱硫的S研究
宁萍莉4441怎么计算产率(化学)
厉宋满13380831796 ______ 用实际生成物比上理论全部反应生成物.比如1molN2,3molH2,理论上生成2molNH3,如果实际生成是1mol,那么产率是1比上2等于50%.
宁萍莉4441化学平衡中的转化率和产率 -
厉宋满13380831796 ______ 转化率是变化的除以原来的,变化的跟系数有关
宁萍莉4441化学反应中的产率是什么?怎么计算? -
厉宋满13380831796 ______ 得到目的产物消耗的理论上的反应物和实际参加反应的反应物的比
宁萍莉4441高中化学 产率 -
厉宋满13380831796 ______ (1)高中化学 产率---产率=实际产量/理论产量 !(2)氨的产率就降低---说法有误!(3)其他条件相同,温度低,平衡右移,氨的产率就高!
宁萍莉4441能否传授一些化学平衡和电离平衡中的重点和难点? -
厉宋满13380831796 ______ 第二章 化学平衡重点难点考点1、化学反应速率的表示方法化学反应速率用单位时间(如每秒、每分或每小时等)内反应物或生成物的物质的量(mol)的变化来表示,通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示.理解化学...
宁萍莉4441化学ks的计算公式
厉宋满13380831796 ______ 化学ks的计算公式是Ks=c(C)*c(D)/c(A)*c(B).ks是指化学平衡常数,是在一定温度下,不考虑反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积与各反应物浓度的化学计量数次幂的乘积的比值是个常数.平衡常数一般有浓度平衡常数和压强平衡常数.另外平衡常数的单位比较复杂,有标准平衡常数和非标准平衡常数之分,前者的量纲为一,意思是根据热力学数据△G计算的,所以就是统一的一个数据,一个间接体现反应的程度的数据,统一的单位意思.后者的量纲取决于平衡常数的表达式所用的物质的物理量.
宁萍莉4441化学平衡的计算 -
厉宋满13380831796 ______ 等效平衡问题是指利用等效平衡(相同平衡或相似平衡)来进行的有关判断和计算问题,即利用与某一平衡状态等效的过渡平衡状态(相同平衡)进行有关问题的分析、判断,或利用相似平衡的相似原理进行有关量的计算.所以等效平衡也是一...
宁萍莉4441..化学平衡的计算,帮忙 -
厉宋满13380831796 ______ 呵 我喜欢化学平衡 第一步:计算有多少N2 H2反应成NH3. 因为反应后的密度为反应前的1.25倍,因此反应后的体积为反应前的 0.8倍,因为在衡温衡压下进行,即mol数也为反应前的0.8倍,即变化的mol数为20mol. N2 + 3H2 = 2NH3 变化的...
宁萍莉4441高二化学, 平衡转化率和转化率区别?他们的公式? -
厉宋满13380831796 ______ 在化学反应中,平衡转化率和转化率是用来描述反应程度的两个重要概念.它们的区别如下: 转化率(Conversion Rate):转化率是指反应物转化为生成物的比例或百分比,通常用于描述反应的进行程度.转化率可以根据不同的情况进行定义...
宁萍莉4441化学平衡转化率怎么算?已消耗的比起始的,但是对于起始有生成物的反应,是把生成物全部换回反应物来算么比如对于:同条件(压强,浓度,温度等)... -
厉宋满13380831796 ______[答案] 是的,反应物的系数比相同 同条件(压强,浓度,温度等)下【条件也相同】 所以转化率相同 生成物全部换回反应物 计算应该说是一种技巧