原子离子半径大小比较方法
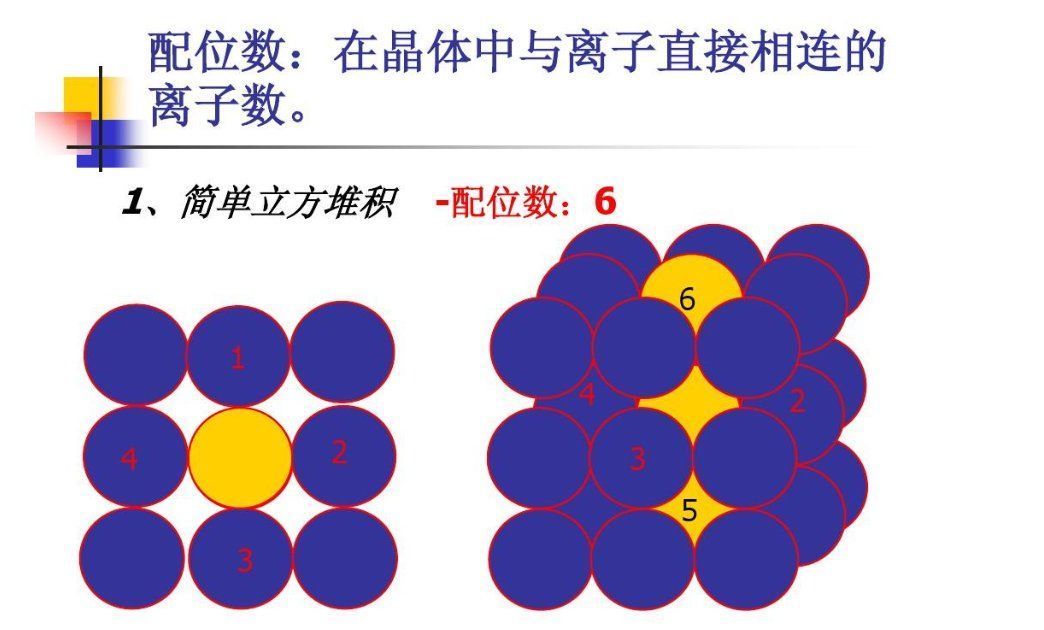
要了解配位数,先得了解晶体结构!
你知道晶体结构是怎么形成的吗?晶体结构是由无数个原子或离子按照一定的规律排列而成的。不同的晶体结构有不同的形状和特性,这取决于原子或离子之间的相互作用。那么,如何衡量原子或离子之间的相互作用呢?

一个重要的指标就是配位数。
配位数是指一颗原子或离子在晶体结构中与其周围的原子或离子相连的个数。配位数越大,说明原子或离子之间的联系越紧密,越能够稳定地存在;配位数越小,说明原子或离子之间的联系越松散,越容易发生变化。
那么,如何计算配位数呢?
有一个简单而有效的方法,就是根据原子或离子的大小来判断。
原子或离子的大小可以用半径来表示,半径就是从原子或离子的中心到其外层电子的距离。如果我们把一个原子或离子看作是一个球体,那么它的半径就是球体的半径。如果我们把两个不同大小的球体放在一起,它们之间会有一定的空隙,这个空隙就是它们之间可以容纳其他球体的空间。
如果我们把一个小球体放在两个大球体之间,它可能会被夹住,形成一个线性型的结构;如果我们把三个小球体放在一个大球体周围,它们可能会形成一个三角平面型的结构;如果我们把四个小球体放在一个大球体周围,它们可能会形成一个四面体型的结构;以此类推,我们可以得到不同类型的晶体结构。

为了方便计算,我们可以用一个比值来表示两个球体之间的大小关系,这个比值就是半径比。半径比是指中心球体(即中心原子或离子)的半径与周围球体(即配位原子或离子)的半径之比。
半径比越大,说明中心球体越大,周围空隙越小,配位数越小;半径比越小,说明中心球体越小,周围空隙越大,配位数越大。根据半径比的大小,我们可以将晶体结构分为以下几种类型:
- 线性型:当半径比小于0.155时,中心球体只能与两个周围球体相连,形成线性型的结构。这就像一根铁丝上穿着两颗珍珠一样。例如,氯化银(AgCl)就是一种线性型的晶体结构,每个银离子(Ag+)只与两个氯离子(Cl-)相邻,配位数为2。
- 三角平面型:当半径比在0.155到0.225之间时,中心球体可以与三个周围球体相连,形成三角平面型的结构。这就像一个三角形的折纸一样。例如,氧化铝(Al2O3)就是一种三角平面型的晶体结构,每个铝离子(Al3+)与三个氧离子(O2-)相邻,配位数为3。
- 四面体型:当半径比在0.225到0.414之间时,中心球体可以与四个周围球体相连,形成四面体型的结构。这就像一个四面体的模型一样。例如,金刚石(C)就是一种四面体型的晶体结构,每个碳原子(C)与四个碳原子(C)相邻,配位数为4。
- 八面体型:当半径比在0.414到0.732之间时,中心球体可以与六个周围球体相连,形成八面体型的结构。这就像一个八面体的魔方一样。例如,氯化钠(NaCl)就是一种八面体型的晶体结构,每个钠离子(Na+)与六个氯离子(Cl-)相邻,配位数为6。
- 立方体型:当半径比在0.732到1之间时,中心球体可以与八个周围球体相连,形成立方体型的结构。这就像一个立方体的积木一样。例如,铜(Cu)就是一种立方体型的晶体结构,每个铜原子(Cu)与八个铜原子(Cu)相邻,配位数为8。
- 其他类型:当半径比大于1时,中心球体可以与更多的周围球体相连,形成其他类型的结构。这就像一个多面体的拼图一样。例如,碘化镉(CdI2)就是一种其他类型的晶体结构,每个镉原子(Cd)与十二个碘原子(I)相邻,配位数为12。
以上是根据半径比来计算配位数的方法,它适用于简单的晶体结构,但对于复杂的晶体结构,可能需要考虑其他因素,如对称性、键角、键长等。因此,配位数的计算并不是一件轻而易举的事情,需要根据具体的情况来判断。

配位数的计算对于理解晶体结构的性质和功能有重要的意义。例如,配位数可以影响晶体的稳定性、硬度、导电性、磁性等。通过计算配位数,我们可以更好地认识晶体的内部结构和外部表现,从而为科学和工程的发展提供有价值的信息。
","gnid":"9ba9e40c6406c5abb","img_data":[{"flag":2,"img":[{"desc":"","height":"642","title":"","url":"https://p0.ssl.img.360kuai.com/t014ee0ea505a5c09f2.jpg","width":"1004"},{"desc":"","height":"630","title":"","url":"https://p0.ssl.img.360kuai.com/t0156dd88d0a85a30da.jpg","width":"1044"},{"desc":"","height":"662","title":"","url":"https://p0.ssl.img.360kuai.com/t0168d68bb0bc219965.jpg","width":"1011"},{"desc":"","height":"598","title":"","url":"https://p0.ssl.img.360kuai.com/t016707c799424d3f7a.jpg","width":"930"}]}],"original":0,"pat":"art_src_3,sexf,sex4,sexc,fts0,sts0","powerby":"hbase","pub_time":1683976860000,"pure":"","rawurl":"http://zm.news.so.com/13bf2db27cb7f4d262282fcaf2ed370c","redirect":0,"rptid":"b4836b7d5e1b3878","rss_ext":[],"s":"t","src":"三乐大掌柜","tag":[],"title":"配位数,一个决定晶体性质和功能的关键因素,你会计算吗?
郑菲乳3728原子,离子的半径如何判断大小 -
郎侮仇18014754318 ______ 简单离子的半径比较, 1.等电子的, 比较质子数, 质子数越大,半径越小, 如 Na+>Mg2+> Al3+ (y因为质子数越大,原子核对电子的吸引力越大, 半径越小) 2.等质子数的, 比较电子数,电子数越大,半径越大, 如 Fe2+>Fe3+3. 同主族的同价态的离子, 质子数越多, 半径越大, Na+>K+ > Rb+
郑菲乳3728怎么判断原子、离子的半径大小?举例子下,刚学听不太懂. -
郎侮仇18014754318 ______[答案] 按照元素周期表就可以了~原子半径同周期从左到右半径逐渐减小;同主族从上到下半径逐渐增大;镧系和锕系半径差不多.离子半径也基本是这个规律 但是离子半径比较的时候,是阴离子和阴离子比,阳离子和阳离子比.外层电子数多的半径大
郑菲乳3728..离子,原子的半径大小如何比较?不同原子的半径大小比较 不同离子半径大小比较 离子和原子半径大小比较 -
郎侮仇18014754318 ______[答案] 一下是我从笔记上摘的,你需要的规律都有,1.对于同种电子层结构的(同一周期)的原子 粒子半径随核电荷数的增大而减小 如Na >Mg>Al>Si 2.对于同种电子层结构的离子 粒子半径随核电荷数的增大而减小 如02->F->Na+>Mg2+...
郑菲乳3728离子半径,原子半径怎么比较大小 -
郎侮仇18014754318 ______ 首先看你的原子周期表,同周期的原子,从左到右,半径原来远大,同主族的原子,从上到下,半径越来远大,而离子分阳离子与阴离子,有时也会让你进行离子与原子的比较,这个较为麻烦,我这只有一点点::不同原子:根据『同周期:原子半径从左到右逐渐减小,同主族:原子半径从上到下原子半径逐渐增大』.不同离子:1:电子层数相同的根据『荷电荷数越大的原子半径越小』,2:不同电子层的:根据『电子层数越多的半径越大』 离子和原子:根据『阴离子的半径大于相应的原子半径,杨离子半径小于相应的原子半径』.,对于离子的比较,我劝你还是到学校问问老师,这样会更清楚,也有保证
郑菲乳3728怎样比较原子半径大小哪位能比较详细地教我一下如何比较元素(原子和原子)(离子和离子)(原子和离子)之间的半径大小.最好能举几个例子.比如钠离... -
郎侮仇18014754318 ______[答案] 1、电子层数相同的原子,最外层电子数越多,半径越小r(Na)>r(Mg) 2、最外层电子数相同的原子,电子层数越多,半径越大,r(Na)
郑菲乳3728离子半径大小比较方法离子半径是不是与原子半径相反?即原子半径的顺序固定后,离子半径是在它的基础上相反(若原子半径a>b>c,是否离子半径c>b>a) -
郎侮仇18014754318 ______[答案] 不完全是.你说的这样的结果符合这样的情况:一种是同一周期内元素的微粒,阴离子半径大于阳离子半径,如硫离子>铝离子,与原子半径的顺序相反;另一种是具有相同电子层结构的离子(单核),核电荷数越小,半径越大,这里也只有阴离子半...
郑菲乳3728粒子半径大小的比较(原子 离子)说详细常用方法 -
郎侮仇18014754318 ______[答案] 以下仅针对主族元素的原子及其单原子离子 同周期元素的原子半径由左至右递减,同族元素的原子半径由上至下递增 同一元素:负离子>原子>正离子 带等量同种电荷的离子,原子序数越大半径越小(吸引力强)
郑菲乳3728化学离子半径怎样比较离子半径的大小? -
郎侮仇18014754318 ______[答案] 要比较微粒半径的大小,可以根据元素间在元素周期表中的位置来判断,它们的判断口诀为: 同层核大半径小,同族核大半径大. 但是,这个口诀只能针对原子半径大小的比较,对于其它微粒,比如离子等的比较则无能为力. 对于其它微粒的比较,...
郑菲乳3728元素的离子半径怎样比较元素离子半径大小 -
郎侮仇18014754318 ______[答案] 在中学阶段的比较,都是比较最外层达到稳定的主族离子半径,也就是最外层8个或2个电子 先看电子层,电子层越少,半径越小 相同电子层,谁的原子序数大谁的半径就小,比如,Na+的半径小于Cl-的半径 好了,应该全面了
郑菲乳3728如何比较离子半径的大小 -
郎侮仇18014754318 ______[答案] ①电子层数.电子层数多,半径大.可以这样理解,电子在原子核外按层排布,类似于洋葱,皮(层)多,洋葱(原子)的半径自然就大.②如果电子层数相同,则比较核电荷数,核电荷多,则半径小.电子层相同时,核电荷越多,原子核对核外电...