常见金属电极电位排序
作者:气泡水嘻嘻嘻
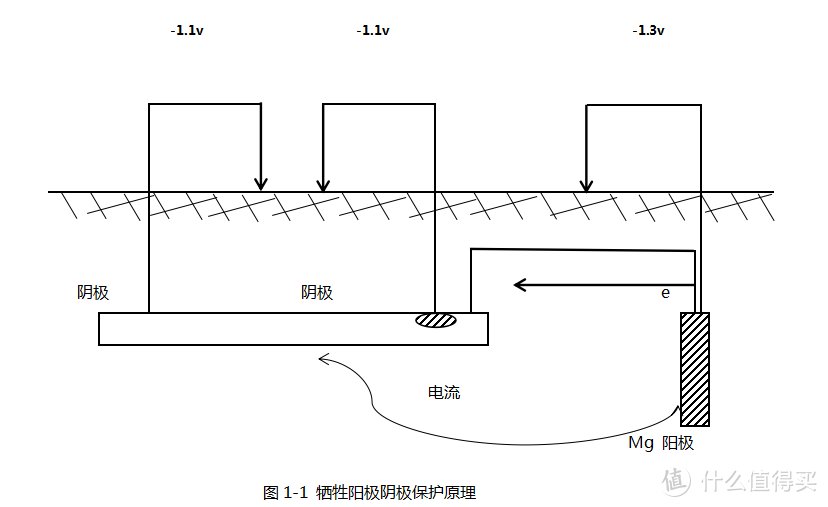
金属炼制过程中需要的能量越多,其活性越强。将不同的金属放入同一电解质溶液,相对于同一参比电极会量现不同的电位值,将金属根据其电位值进行排序,即得到金属活性顺序,可以比较不同金属的相对活性。如果将两种金属用导线连接,电子就会从电位低的金属流向电位高的金属。牺牲阳极阴极保护的原理就是利用不同金属的电位差异,为受保护的金属提供电子,使被保护金属整体处于电子过剩的状态,表面各点电位降低到同一负电位,使金属表面各点之间不再有电位差,不再有电子的流动,金属原子不再失去电子而变成离子溶入溶液,最终达到减缓腐蚀的目的。由于在实现阴极保护过程中,较活泼的金属为阳极,被腐蚀,所以,被称为牺牲阳极阴极保护。其原理如图1-1所示。

阅读更多五金工具精彩内容,可前往什么值得买查看
","gnid":"94b18fe23edf3c697","img_data":[{"flag":2,"img":[{"desc":"","height":"507","title":"","url":"https://p0.ssl.img.360kuai.com/t012768effc2f1aff13.jpg","width":"828"},{"desc":"","height":1280,"title":"","url":"https://p0.ssl.img.360kuai.com/t01eb73e897d91b851b.jpg","width":960}]}],"original":0,"pat":"art_src_1,fts0,sts0","powerby":"pika","pub_time":1709109098000,"pure":"","rawurl":"http://zm.news.so.com/c3ff67b178e09a7d3fc01d5eae707570","redirect":0,"rptid":"ce2877dc6830b114","rss_ext":[],"s":"t","src":"什么值得买","tag":[{"clk":"ktechnology_1:电子","k":"电子","u":""}],"title":"牺牲阳极阴极保护 篇四:镁合金牺牲阳极保护原理
利钱富2276Fe3+, Fe2+, I离子,Br离子,氯离子 还原性顺序 -
隗世郎14786864102 ______ 解:按还原性依次减弱排,I->Fe2+>Br->Fe3+.理由如下:由2Fe3++2I-=2Fe2++I2知碘离子还原性较二价铁强(还原剂较还原产物还原性强);由2Fe2++2Br2=Fe3++2Br-知Fe2+较Br-强(理由同上); 因为Fe3+的氧化性较Br-强,所以还原性Br-强,可以说Br-没有氧化性吧.所以排列有如上结果.
利钱富2276ClO - MnO4 - NO3 - Fe3+的氧化性强弱排序,酸性条件下← - ← -
隗世郎14786864102 ______ 根据标准电极电位进行氧化性强弱排序,顺序如下:1)MnO4-:1.51伏2)NO3-:0.94伏3)C1O-:0.89伏4)Fe3+:0.771伏特
利钱富2276非金属及一些离子的氧化性还原性强弱顺序是什么? -
隗世郎14786864102 ______[答案] 氧化剂易于得到电子,具有氧化性.还原剂易于失去电子,具有还原性.所谓氧化性,是指具有氧化别的元素的能力,即夺取... 由此可见,元素的金属性的强弱跟它的还原性强弱是一致的.常见金属的活动性顺序,也就是还原性顺序. 许多非金属元素的原...
利钱富2276如何判断哪些离子易失电子,例如SO42 -
隗世郎14786864102 ______ 1.阴极上是阳离子放电:依照的是金属活动顺序表..排在越前的金属离子越难放电 Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+ 离子氧化性越强越先放电2.阳极上是阴离子放电 S2->I->Br->Cl->OH->SO42->NO3->F- 阴离子还原性越强越先放电3.特殊情况:若接电源正极的阳极材料为活泼金属(即H) 的话,则金属本身放电,轮不到阴离子
利钱富2276求一个比较全的金属活动性顺序表. -
隗世郎14786864102 ______ Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 以上就是各金属的大概顺序表,实际上,象Os,Ir,Ru,Pd,Rh,等副族元素的金属活动性相差很小,而且与具体反应条件有关.
利钱富2276帮忙排活动性顺序表 -
隗世郎14786864102 ______ 金属性活动顺序表 K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au 金属阳离子氧化性是金属活动顺序表的倒序, 非金属活动顺序表 F2> Cl2> O2> Br2 >I2 >S >N2> P >C >Si >H2 非金属阴离子的还原性为上表的倒序 常见的氧化还原 氧化性:KMnO4>Cl2>Br2>Fe3+>I2>SO2>S 还原性:S2―>SO32―>I―>Fe2+>Br―>Cl― 不知你还要什么
利钱富2276原电池装置的详细情况是怎样组成的
隗世郎14786864102 ______ 实际上,两种具有不同电极电位的金属片,插入于同一容器内的盐溶液内时,两金属片及盐溶液就组成一个原电池,较活泼的金属电极电位较低,为原电池的负极,较不活泼的金属电极电位较高,是该原电池的正极. 典型的锌、铜组成的原电池组成见附图,较详细的解释可参看附图上网址内,关于金属电极电位的介绍. 用两手指,沾上盐水(甚至唾沫),同时捏住互不相碰的一把铜钥匙和一把铝钥匙,也可以得到一个原电池:铜钥匙为电池正极,铝钥匙为电池负极,这个电池可以驱动灵敏电流表指针转动; 同样,将一把铜钥匙和一把铝钥匙插到一个西红柿上,注意两钥匙不能相接触,也能得到一个原电池,有报道,适当串、并联这西红柿原电池,还可以使半导体收音机工作.
利钱富2276阳极金属先放电子还是负离子,比如是铜为阳极,但是电解质是CuSO4 -
隗世郎14786864102 ______ 阳极为金属进,金属先放电,然后再到阴离子放电
利钱富2276高中化学所有离子的氧化性排序 -
隗世郎14786864102 ______ 主要根据元素周期表的分布 由上到下还原性逐渐增强 由左到右 氧化性逐渐增强 一般金属显还原性强 非金属显氧化性 但强弱不是根据得失电子数目决定而是得失电子的难易程度 有个规律 钾钙钠镁铝 锌铁锡铅氢 铜汞银铂金 还原性依次减弱 氧化性依次增强 还有比较常考的是碱金属和卤素 主要根据元素周期律 金属的最高价阳离子没有还原性 而非金属的最低价阴离子没有氧化性 具有强氧化性的有 酸性高锰酸钾 双氧水 氯气 等 具有强还原性的有 (SO3)2- I- 等 希望对你有帮助!
利钱富2276金属腐蚀过程中 电极电位的变化 -
隗世郎14786864102 ______[答案] 金属腐蚀一般为电化学腐蚀,发生腐蚀---构成腐蚀原电池,一般阳极电极电位负移,阴极电极电位正移,构成材料的腐蚀电位. 金属表面阳极和阴极的初始电位分别为E a 和E c.金属腐蚀时,由于极化作用,阳极和阴极的电位都接近于交点S 所对应的...