水中氢键的结构示意图
摘要
使用水基电解质的锌离子电池(ZIBs)引起了广泛关注。然而,在恶劣的条件下,ZIBs内部会积累极高的热量,这不可避免地会导致热跑道风险。因此,可充电 ZIBs 的实际应用受到了极大的限制,因为恶劣条件下积累的内部热量会导致剧烈的膨胀甚至爆炸。为了克服这一限制,科研人员报道了一种自适应温度调节水凝胶电解质(TRHE),它通过氢键相互作用将具有吸热效应的相变链整合到琼脂糖骨架中。在极端条件下,TRHE 可以承受突然的热冲击;因此,ZIBs 可以在环境(100°C)中正常运行一段时间,因为它们具有热自调节特性,从而缓解了与电池相关的热问题。具有均匀离子迁移通道的水凝胶网络可以加速离子迁移,使离子分布均匀,实现对枝晶的抑制;此外,还可以有效解决其他紧迫问题,包括析氢和锌腐蚀,这对出色的电化学性能有很大贡献。据信,所提出的 TRHE 将有助于克服 ZIB 和其他水性电池中的热失控。
介绍
现代电池因其高能量密度、良好的循环稳定性和先进的制造技术而被广泛用于从智能手机到电动汽车的不同应用。然而,如果这些风险不受控制,由恶劣条件引发的热失控可能会导致爆炸、火灾甚至人员伤亡。火灾主要是由高度易燃的有机电解质引起的;为避免此类事故,应使用不易燃的电解液。因此,使用水基电解质的水系锌离子电池(ZIBs)引起了人们的极大关注。在温度突然升高、机械冲击或电气滥用(过度充电或短路)等滥用条件下,ZIBs 内部会积聚极高的热量,这不可避免地会导致热跑道风险,从安全角度来看,会出现各种问题(膨胀或短路)。甚至由产生的氢气或蒸汽引起的爆炸)、电极稳定性和电池系统。尽管 ZIBs 中由热失控引起的安全问题无法与使用有机电解质的 LIBs 相比,但 ZIBs 中仍然存在问题。水的快速挥发和内部压力的增加导致电池急剧膨胀甚至爆炸。此外,由于极端高温导致水活性增强,氢气析出加剧,这增加了燃烧和爆炸的风险。水与电极的其他副反应,包括腐蚀、锌负极中的枝晶生长以及正极的不可逆结构变化(塌陷和溶解),也会加剧,从而导致性能下降。特别是对于电池组,不稳定的局部热风险会从初始电池扩散到其相邻电池,从而导致严重的连锁反应,并在系统层面造成灾难性的失控后果。因此,ZIBs中的热失控也是一个重要课题,在实际应用之前迫切需要解决。开发能够对热刺激做出响应和自适应的 ZIBs 是延长 ZIBs 使用寿命、提高其运行稳定性和安全性的一种
主图导读
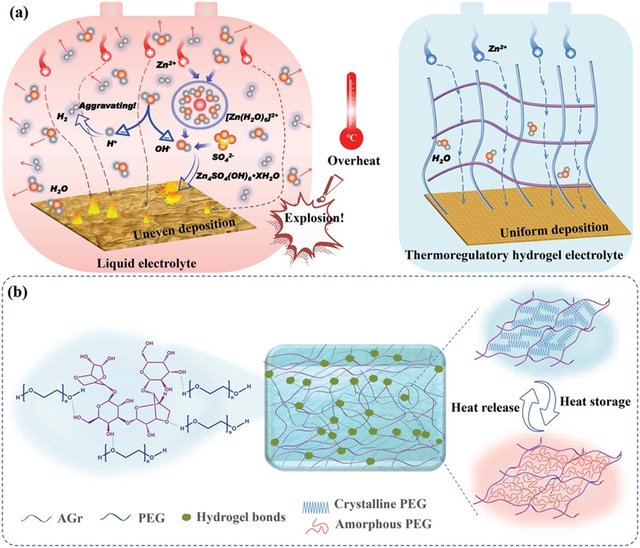
图1 a) 液体电解质和温度调节水凝胶电解质中的热问题示意图。b) 温度调节水凝胶电解质的组成和温度调节机制。
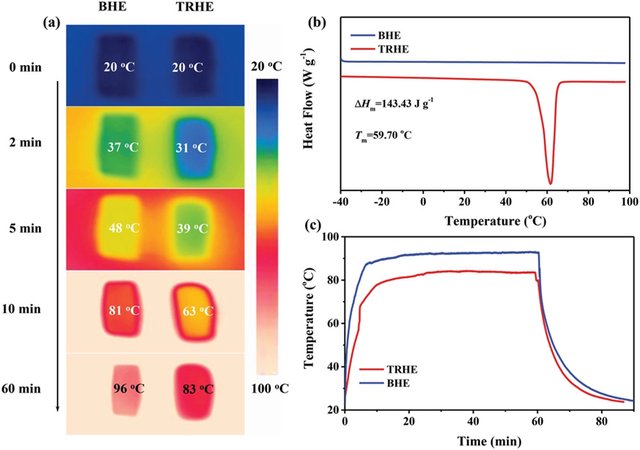
图2 a) BHE 和 TRHE 的红外热图像。温度在 10 分钟内从室温升至 100 °C,并在 100 °C 下保持 50 分钟。b) BHE 和 TRHE 的 DSC 曲线。c) BHE和TRHE的加热温度曲线,温度保持在100°C 60 min。
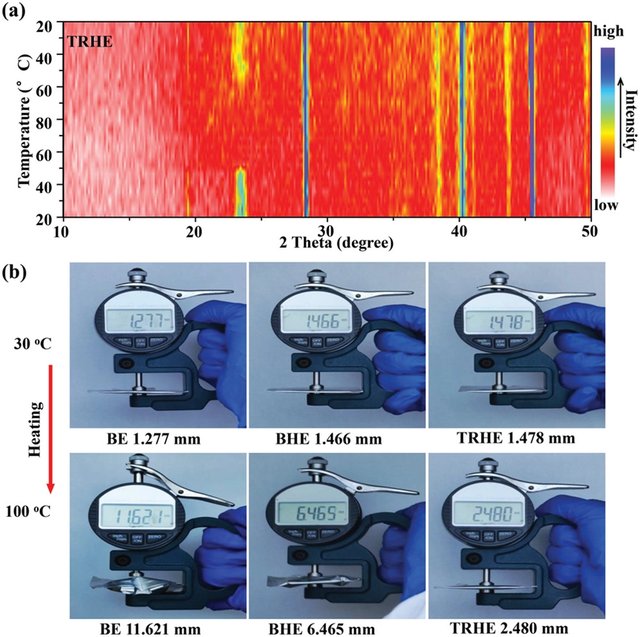
图3 a)TRHE在加热和冷却过程中的原位XRD图谱。b) 使用 BE、BHE 和 TRHE 对充满电的软包电池在 30 至 100 °C 的温度升高期间进行热滥用测试。

相关论文以题为Developing Thermoregulatory Hydrogel Electrolyte to Overcome Thermal Runaway in Zinc-Ion Batteries发表在《Advanced Functional Materials》上。通讯作者是南通大学Yufeng Cao,Jinqiu Zhou,和钱涛特聘教授。
参考文献:
doi.org/10.1002/adfm.202206653
晏凡逃2559水的结构是什么 -
杜虽哪13573962581 ______ 水是一个角状分子,氧原子位于顶点,氢原子位于两侧,与氧原子用共价键连接,两个共用电子云之间有104.5度的夹角,这个特殊的角度使得水及其稳定,也使得水在同类物质中熔点和沸点最高,比热最大.在液态水中,不同水分子之间的氢原子和氧原子会产生电磁力的引力,这就是氢键,因为水分子中的氢原子带正电,氧原子带负电.这种氢键十分脆弱,每个水分子可以与其他1到4个水分子以氢键结合.由于氢键脆弱,这种结合很不稳定,水分子之间的结合关系不断变化,通常一个宏观水体中同时有19%的水分子是相互联系的.而冰是晶体,每一个水分子都同时和其他4个水分子以氢键连接,形成蜂巢状结构,比较疏松,所以冰总是飘在水面上.这样说你明白了么?
晏凡逃2559H2O分子间通过“氢键”相互连接形成庞大的分子晶体,晶体中每个H2O分子被4个H2O分子包围形成变形的四面体,其结构示意图如图所示,则晶体中,1... -
杜虽哪13573962581 ______[答案] 在冰晶体中,一个水分子与周围四个水分子形成正四面体结构,一个水分子可以形成四个氢键,而二个水分子共一个氢键,故一个水分子可形成二个氢键,1mol冰晶体中存在2mol氢键. 故选B.
晏凡逃2559氢键 氨水的结构式 -
杜虽哪13573962581 ______ 因为O的电负性比N大,因此水中的H上的正电荷更多,更能吸引负电荷.定性说只能这样了,更具体的楼主另请高明吧.
晏凡逃2559为什么液态水的氢键小于冰的氢键 -
杜虽哪13573962581 ______ 在液态水中,经常是几个水分子通过氢键结合起来;在冰中,水分子大范围地以氢键互相联结,形成疏松的晶体,从而在结构中有很多空隙,造成体积膨胀,密度较小,所以,液态水的氢键小于冰中的氢键.
晏凡逃2559氢键是怎么影响冰的密度比水小的 -
杜虽哪13573962581 ______ 由于在水蒸气中水是以单个的H2O分子形式存在. 而在液态水中,经常以几个水分子通过氢键结合起来,形成(H2O)n.在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小.
晏凡逃2559谁知道:用微粒的观点解释水结成冰时体积变大微粒的观点即分子的观点
杜虽哪13573962581 ______ 氢键与水的反常膨胀中学物理讲到水的反常膨胀:水结成冰和水由4℃降至0℃的过程中体积都膨胀.为什么会出现这种反常膨胀的现象呢这必须从物质热胀冷缩的机制和水...
晏凡逃2559如何解释“氢键”这个名词无氢键相互作用的溶质在有氢键的水中的溶解性比较小,如:H2S和H2O都为极性分子,但是H2S和H2O之间无氢键,故H2S在水... -
杜虽哪13573962581 ______[答案] 定义定义1:氢原子与电负性的原子X共价结合时,共用的电子对强烈地偏向X的一边,使氢原子带有部分正电荷,能再与另一个电负性高而半径较小的原子Y结合,形成的X—H┅Y型的键. 所属学科: 生物化学与分子生物学(一级学科)...
晏凡逃2559水的结构是什么?
杜虽哪13573962581 ______ H2O 分子有极性,为角形,是由于氧原子还有2对孤对电子的排斥作用形成的,固态水分子间还存在氢键,常温下,水中仍留存96%的氢键,到气态水时,氢键则完全被破坏
晏凡逃2559为什么冰体积比水大? -
杜虽哪13573962581 ______ 液态水,除含有简单的水分子(H2O)外,同时还含有缔合分子(H2O)2和(H2O)3等,当温度在0℃水未结冰时,大多数水分子是以(H2O)3的缔合分子存在,当温度升高到3.98 ℃(101 kPa)时,水分子多以(H2O)2缔合分子形式存在,分子占据空间相对减小,此时水的密度最大.如果温度再继续升高在3.98 ℃以上,一般物质热胀冷缩的规律即占主导地位了.水温降到0 ℃时,水结成冰,水结冰时几乎全部分子缔合在一起成为一个巨大的缔合分子,在冰中水分子的排布是每一个氧原子有四个氢原子为近邻(两个共价键,两个氢键),如下图所示.这样一种排布导致成一种敞开结构,也就是说冰的结构中有较大的空隙,所以冰的密度反比同温度的水小.
晏凡逃2559氟化钡的物质结构 -
杜虽哪13573962581 ______ 氟化钡是碱土氟化物晶体,无色透明,属于立方晶体系,面心立方结构型(见图1 a).是配位型晶体,每个钡原子周围有八个氟离子包围,构成阴离子立方休结构基元(见图1 b),而F被四个Ba所环绕构成四面体结构基元,Ba位于立方面心格位呈紧密堆积(见图1 c).固态氟化钡为萤石型晶体结构,立方晶系.高压下转变为氯化铅型结构.气态时,以 BaF2 分子的形式存在,F-Ba-F 键角约为 108°,与价层电子对互斥理论的预测相矛盾. 从头计算的结果显示这是钡原子的 d 轨道参与的结果. 也有理论认为这是由钡内层电子的极化作用,在钡原子周围产生四面体型的电荷分布,并与 Ba-F 键发生作用造成的.