铁与浓硫酸钝化方程式
简介:氯化氢乙醇溶液 又称盐酸乙醇溶液,性状为无色透明液体,其中氯化氢质量分数为30%~37%,是一种重要的化学物质,具有广泛的应用价值。
本品为无水HCl乙醇溶液,仅为生物医药中间体供科研,不作为药物用途。使用个人需佩戴好防护装备,避免吸入蒸汽、气雾或气体。
保证充分的通风,消除所有火源,及时清除地面低洼处蓄积的蒸气。
氯化氢乙醇溶液用途:
盐酸乙醇是常用的非水成盐溶液,用于一些碱性有机物的成盐反应(因为有机物常常不溶于水而易溶于乙醇等有机溶剂),如有机胺类。
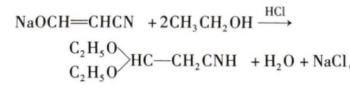
盐酸乙醇可用于胞嘧啶的生产。目前工业化生产胞嘧啶的主要方法是Pinner合成法,是以3-烷氧基丙烯腈或3,3-烷氧基丙腈为原料合成胞嘧啶。3-烷氧基丙烯腈和3,3-烷氧基丙腈均主要通过一个中间体3-羟基丙烯腈金属盐在醇的酸溶液中反应得到,以3-羟基丙烯腈钠和乙醇为例的反应式如下:
盐酸乙醇的生产工艺流程及主要生产设备
工艺流程
来自氯氢车间的氯化氢气体经石墨冷却器降温,酸雾捕集器分离酸雾,干燥釜(浓硫酸为干燥剂)干燥,丝网过滤器过滤后进入一级吸收釜与乙醇进行混合吸收,逸出的氯化

危险源及危险有害因素分析
生产过程涉及的物料主要有:无水乙醇、氯化氢、浓硫酸、氯化钙溶液(载冷剂)、氢氧化钠、盐酸乙醇等。乙醇具有可燃性和爆炸性,氯化氢具有毒性,浓硫酸、氢氧化钠具有腐蚀性。
生产及储存过程中的主要危险因素有:泄漏、火灾、爆炸、中毒等。
工艺系统
工艺过程中的主要措施
(1)防泄漏措施。工艺系统中的设备、管道、阀门等工装装置的防泄漏,最本质上取决于系统中的设备、管道、阀门等的选型和材质的设计。盐酸乙醇车间管子、管件、法兰、阀门选用增强聚丙烯,垫片聚四氟乙烯,螺栓8.8级,螺母8级。乙醇管道焊接完成后进行酸洗与钝化处理,并以洁净水进行设计压力1.5倍的压力试验。各种储罐、吸收釜等设备基础稳固,防止基础沉降引起管道应力破坏。
(2)防火、防爆。盐酸乙醇车间、盐酸乙醇堆放场、罐区火灾危险性甲类,耐火等级二级,防爆电气级别为ExdⅡAT2,为工作人员配备防爆工具;盐酸乙醇配电室、控制室火灾危险性丁类,耐火等级二级。①乙醇罐区设防火堤。②在盐酸乙醇车间和罐区设置带有声光报警的可燃气体检测装置,报警信号发送至操作人员常驻的控制室进行报警。③盐酸乙醇车间安装与可燃气体检测报警器联锁的防爆轴流风机,一旦发生物料泄漏,立即自动启动通风系统.避免造成乙醇蒸气聚集。排出口高出屋面3.5m。④盐酸乙醇车间、罐区所有设备、管道、法兰做好防静电跨接,在乙醇车间、罐区入口处设人体静电释放器。⑤乙醇储罐通气管管口安装呼吸阀和阻火器,通气管采用DN50的输送流体用无缝钢管。⑥罐区采用密闭卸料方式,槽车卸料时使用专用静电接地报警仪,卸料连通软管采用导静电耐油软管。⑦选择装卸泵流量、管径,保证管道内乙醇的流速小于3m/s。⑧盐酸乙醇堆放场设遮阳棚。
(3)防毒。生产过程中使用有毒物质氯化氢,车间采用机械化、自动化、密闭化、管道化生产,并有良好的尾气吸收系统。操作人员佩戴化学安全防护眼镜,穿防静电工作服,佩戴防化学品手套;工作场所浓度超标时,必须佩戴防毒面具,紧急事态抢救时,必须佩戴正压自给式空气呼吸器。
(4)防腐蚀。盐酸乙醇车间为腐蚀性环境,主要腐蚀性介质为HCl,硫酸、烧碱(用量较少)也具有腐蚀性。①涉及盐酸、硫酸、氢氧化钠的设备、管道、管件、阀门、垫片等均采用相应耐腐蚀的材质。②选用电气设备防腐类型为F2型。③车间钢筋混凝土基础和其他混凝土构件喷涂聚氨酯防腐涂料(或聚合物水泥砂浆),裸露的钢结构采用除锈并刷涂聚氨酯耐酸漆(或沥青漆)进行防锈,生产中每年还应重新刷涂。
(5)防超温。吸收釜、冷却吸收釜夹套分别通5℃冷冻水和冷盐水,及时移出热量。吸收釜设温度高限值报警,高高限联锁关闭氯化氢进料阀。乙醇储罐设保温层,当环境温度较高时,起隔热作用。
(6)防超液位。乙醇储罐设高液位报警,高高液位联锁停卸车泵。

正常工况与非正常工况下危险物料的安全控制措施
(1)正常工况下的工艺控制措施。盐酸乙醇车间吸收釜、冷冻吸收釜设温度监测控制调节系统。
(2)非正常工况下的工艺控制措施。各运转设备设置紧急停机按钮,当现场发生意外时工艺设备/p>
采取的其他工艺安全措施
(1)室外水管设保温,防止冬季结冰。
(2)淋洗器、洗眼器选用防冻型安全喷淋洗眼器。
强软荷1091Fe和浓硫酸反映方程式 -
屠力玉13590812205 ______[答案] 冷的浓硫酸会使铁表面钝化,阻止进一步反应 与浓硫酸加热时 2Fe+6H2SO4===Fe2(SO4)3+3SO2+6H2O
强软荷1091硫酸和铁反应的方程式 -
屠力玉13590812205 ______[答案] 稀硫酸 Fe+H2SO4=FeSO4+H2↑ 浓硫酸:常温低温的时候发生钝化 浓硫酸:加热条件:2Fe+6H2SO4(浓)=△=Fe2(SO4)3+3SO2↑+6H2O (铁少量) Fe+2H2SO4(浓)=△=FeSO4+SO2↑+2H2O(铁足量)
强软荷1091铁与浓硫酸反应 钝化 的方程式 还有那个热浓硫酸 冷浓硫酸怎会回事 -
屠力玉13590812205 ______[答案] 3Fe+4H2SO4=Fe3O4+4SO2↑+4H2O 冷的会钝化,热的就并不会了
强软荷1091Fe和浓硫酸反映方程式 -
屠力玉13590812205 ______ 冷的浓硫酸会使铁表面钝化,阻止进一步反应 与浓硫酸加热时 2Fe+6H2SO4===Fe2(SO4)3+3SO2+6H2O
强软荷1091浓H2SO4与Fe钝化方程式 -
屠力玉13590812205 ______[答案] 3Fe+4H2SO4(浓)=Fe3O4↓+4SO2↑+4H2O 体现了H2SO4的强氧化性
强软荷1091求三个化学方程式求铁和浓、稀HNO3反应及与浓H2SO4反应“钝化”的化学方程式,谢谢. -
屠力玉13590812205 ______[答案] Fe + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑ 3Fe + 8HNO3(稀) = △ 3Cu(NO3)2 + 4H2O + 2NO↑ Fe + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑
强软荷1091浓硫酸用铁制容器储存铁钝化的化学方程式 -
屠力玉13590812205 ______ 1L写的是Fe和H2SO4在加热条件下反应的方程式,应该生成了一层致密的Fe3O4薄膜,方程式为3Fe+4H2SO4=Fe3O4+4H2O+4SO2.
强软荷1091Fe、Al与浓硫酸的钝化反应方程式? -
屠力玉13590812205 ______ 主要是由于Fe,Al的表面产生了一层氧化膜阻止了Fe,AL的继续反应.如果一定要求你写钝化反应,可以写Fe,Al的氧化方程式.(实际反应应该更复杂)3Fe+4H2SO4=Fe3O4+4SO2↑+4H2O 3Fe+8HNO3=Fe3O4+8NO2↑+4H2O 2Al+3H2SO4=Al2O3+3SO2↑+3H2O 2Al+6HNO3=Al2O3+6NO2↑+3H2O 生成的氧化物很致密,可以保护金属不再与酸进行反应
强软荷1091铁和硫酸化学方程式 -
屠力玉13590812205 ______ 稀硫酸和浓硫酸不 铁和稀硫酸的反应, Fe+H2SO4=FeSO4 + H2↑ 铁和浓硫酸在常温下的钝化, 但是铁和浓硫酸在加热情况下就会反应了,现象和铁的量,硫酸的量有关,即 2Fe+6H2SO4(浓)=(加热)Fe2(SO4)3+3SO2↑+6H2O 这一...
强软荷1091铁与足量浓硫酸反应的化学反应方程式? -
屠力玉13590812205 ______[答案] 铁和浓硫酸加热可反应Fe+2H2SO4=FeSO4 +SO2+2H20 铁和稀硫酸反应:Fe + H2SO4 = FeSO4 + H2 铁和冷浓硫酸发生钝化,不反应