cu和硝酸
你可能知道,金属元素有不同的活泼程度,有些金属很容易与其他物质发生反应,有些金属则很难被氧化或还原。那么,如果让两种不同活泼性的金属相遇,会发生什么呢?今天,我们就来看看铜和硝酸银之间的反应,它是一种典型的置换反应,也是一场金属之间的较量。

什么是置换反应?
置换反应是指一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应。例如,铁钉放在蓝色的硫酸铜溶液中,会发生如下的反应:
Fe+CuSO4=FeSO4+Cu
这个反应中,铁钉与硫酸铜溶液中的铜离子发生了置换,生成了硫酸亚铁溶液和红色的铜粉。我们可以看到,溶液的颜色由蓝色变成了淡绿色,而铁钉表面覆盖了一层红色沉淀。

铜和硝酸银之间为什么会发生置换反应?
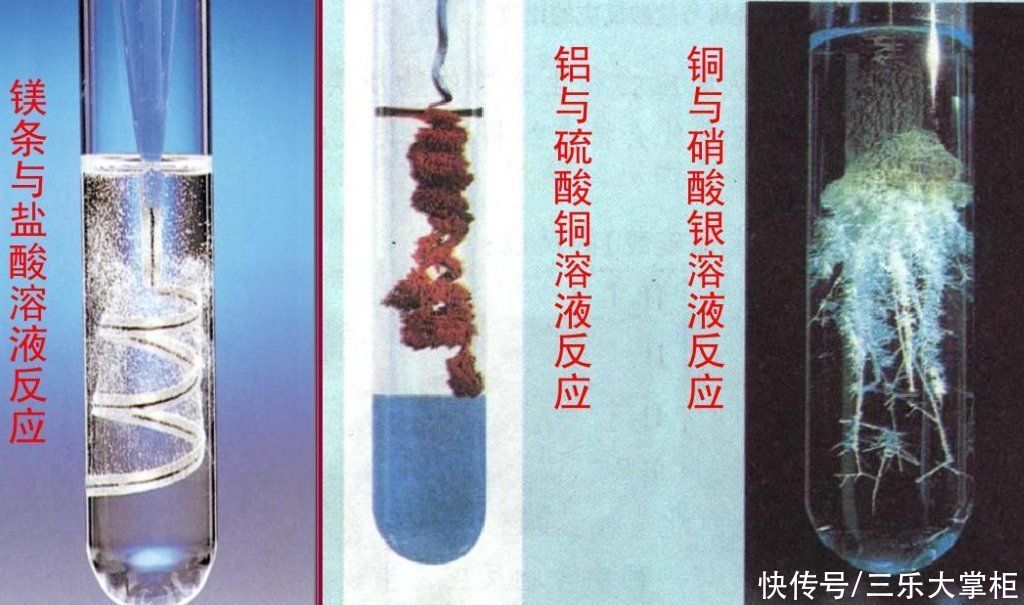
我们知道,硝酸银是一种无色晶体,它能够溶于水,形成无色透明的溶液。硝酸银溶液中含有大量的银离子(Ag+),它们具有较强的氧化性,并且对有机物有腐蚀作用。如果我们把一根铜丝放入硝酸银溶液中,会发生什么呢?
Cu+2AgNO3=Cu (NO3)2+2Ag
这个反应中,铜丝与硝酸银溶液中的银离子发生了置换,生成了硝酸铜溶液和银白色的金属银。我们可以看到,溶液的颜色由无色变成了蓝色,而铜丝表面附着了一层亮闪闪的固体。
那么,为什么会发生这样的反应呢?原因就在于金属元素的活泼性不同。活泼性是指金属元素在氧化还原反应中失去电子(被氧化)或得到电子(被还原)的能力。铜比银活泼,
所以铜能够抢走硝酸银中的银离子,让它们变成单质的银。这样,一个氧化还原反应就完成了。
那么,在实验现象上,我们又能看到什么呢?首先,我们要知道硝酸银是一种无色晶体,它能够溶于水,形成无色透明的溶液。硝酸银溶液中含有大量的银离子(Ag+),它们具有较强的氧化性,并且对有机物有腐蚀作用。如果我们把一根铜丝放入硝酸银溶液中,会发生什么呢?
我们会看到,在铜丝与硝酸银溶液接触的地方,很快就会出现一层亮闪闪的固体。这些固体就是单质的银,它们从溶液中沉淀出来,附着在铜丝上。随着时间的推移,这层固体会越来越厚,直到把整根铜丝都包裹起来。这时候,我们就可以用镊子把这根“变成”了银的铜丝取出来,看看它的外观和质量。
铜和硝酸银之间的反应应用和意义
铜和硝酸银之间的反应不仅是一种有趣的化学现象,也是一种有用的化学方法。我们可以利用这个反应来制备金属银,或者用来检验铜的纯度。我们还可以利用这个反应来制作一些美丽的工艺品,或者用来进行一些科学探究。
例如,我们可以用这个反应来制作一些银镜。银镜是一种镀有一层金属银的玻璃,它能够反射光线,形成清晰的影像。我们可以把一块玻璃放在一个装有硝酸银溶液和少量葡萄糖的容器中,然后把一根铜丝悬挂在溶液上方。这样,就会发生如下的反应:
Cu+2AgNO3=Cu (NO3)2+2Ag
C6H12O6+6O2=6CO2+6H2O
在这个反应中,铜丝与硝酸银溶液发生了置换反应,生成了金属银;而葡萄糖与溶液中的氧气发生了氧化反应,生成了二氧化碳和水。这样,就会在玻璃上形成一层均匀而细腻的金属银膜,也就是银镜了。

我们还可以用这个反应来制作一些有趣的图案或文字。我们可以在一张纸上用蜡笔画出我们想要的图案或文字,然后把纸浸泡在硝酸银溶液中,再把纸贴在一块铜板上。这样,就会发生如下的反应:
Cu+2AgNO3=Cu (NO3)2+2Ag
纸上没有蜡笔覆盖的地方会被硝酸银溶液渗透,然后与铜板发生置换反应,生成金属银;而纸上有蜡笔覆盖的地方则不会被硝酸银溶液渗透,也不会发生置换反应。这样,就会在纸上形成由金属银组成的图案或文字,而周围则是白色的纸张。
通过这些例子,我们可以看到,铜和硝酸银之间的反应不仅能够展示化学原理和现象,也能够激发我们的创造力和想象力。我们可以利用这个反应来进行更多的探索和实践,发现更多的化学乐趣。
","gnid":"95516b3c6010f446c","img_data":[{"flag":2,"img":[{"desc":"","height":"571","title":"","url":"https://p0.ssl.img.360kuai.com/t01e143a67e7033ee84.jpg","width":"946"},{"desc":"","height":"675","title":"","url":"https://p0.ssl.img.360kuai.com/t01b34335a1d8252502.jpg","width":"1188"},{"desc":"","height":"605","title":"","url":"https://p0.ssl.img.360kuai.com/t0103f64c28612552e4.jpg","width":"1024"},{"desc":"","height":"599","title":"","url":"https://p0.ssl.img.360kuai.com/t012dbc0746a67173cf.jpg","width":"1029"}]}],"original":0,"pat":"art_src_3,fts0,sts0","powerby":"hbase","pub_time":1684250760000,"pure":"","rawurl":"http://zm.news.so.com/5fd87d41edc67e064cceb7ddbb130071","redirect":0,"rptid":"340dfddca20936da","rss_ext":[],"s":"t","src":"三乐大掌柜","tag":[],"title":"铜和硝酸银:一场金属之间的较量
甄耍蚁1435铜与浓硝酸反应的方程式和离子方程式 -
时泽裘18534291830 ______[答案] Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2OCu+4H++2NO3-=Cu2++2NO2↑+2H2O铜和浓硝酸反应随着反应的进行,浓硝酸渐渐变成稀硝酸,铜与稀硝酸反应是要加热的(所以铜与稀硝酸反应速度慢)与浓硝酸的反应式:Cu+4HNO3=Cu(NO3)2...
甄耍蚁1435Cu与稀硝酸反应的离子方程式和化学方程式 -
时泽裘18534291830 ______[答案] 化学反应式 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 离子反应式 3Cu+ 8H+ +2NO3- = 3Cu2+ + 2NO↑ +4H2O
甄耍蚁1435求铜和硝酸反应方程. -
时泽裘18534291830 ______[答案] Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)==3Cu(NO3)+2NO↑+4H2O
甄耍蚁1435Cu和硝酸分别生成什么
时泽裘18534291830 ______ 铜与浓硝酸反应生成水,硝酸铜,和二氧化氮 铜与稀硝酸反应生成水,硝酸铜,和一氧化氮 方程式: Cu+4HNO3(浓)==Cu(NO3)2+2H2O+2NO2 3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO
甄耍蚁1435铜与硝酸反应: -
时泽裘18534291830 ______ 如果题目未提示是浓还是稀,一般以稀硝酸答题:铜与稀硝酸:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 如果要写两个,下面是浓硝酸 铜与浓硝酸:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
甄耍蚁1435铜放入浓硝酸的化学方程式铜过量了的反映啊谢谢啊先是铜与硝酸反映后铜有剩余然后的化学方程式是什么啊 -
时泽裘18534291830 ______[答案] Cu不能放H2,因为浓硝酸具有强氧化性,况且铜是氢后金属不可能产生氢气的. 它与浓硝酸的反应式:Cu+4HNO3=Cu(NO3)2+2NO2^+H2O 它与稀硝酸反应式为:3Cu+8HNO3===3Cu(NO3)2+2NO^+4H2O
甄耍蚁1435铜与硝酸硫酸反应的离子方程式是什么! -
时泽裘18534291830 ______[答案] 和稀硝酸:3Cu+8H+ +2NO3-==3Cu2+ +2NO↑+4H2O 和浓硝酸:Cu+4H+ +2NO3- ==Cu2+ +2NO2↑+2H2O 和浓硫酸:Cu+2H2SO4==CuSO4+SO2↑+2H2O 浓硫酸中水极少,硫酸以分子形式存在,所以该反应不属于离子反应,无离子方程式
甄耍蚁1435铜和硝酸可以反应吗 -
时泽裘18534291830 ______ 它与浓硝酸的反应式: Cu+4HNO3=Cu(NO3)2+2NO2^+H2O 它与稀硝酸反应式为:3Cu+8HNO3===3Cu(NO3)2+2NO^+4H2O 浓和稀 的硝酸 都可以 和铜 反应..
甄耍蚁1435铜与硝酸反应机理铜与硝酸反应的具体过程,以及其反应过程中的电子转移,中间产物,等其他不同关于此反应的具体内容 -
时泽裘18534291830 ______[答案] 1.铜与浓硝酸反应: Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O 在加热条件下,生成硝酸铜、二氧化氮和水 Cu 两个自由电子分别转移给两个N,正5价N还原为正四价N,生成NO2 2.铜与稀硝酸反应: 3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O 在加...
甄耍蚁1435cu和浓硝酸反应生成什么啊? -
时泽裘18534291830 ______ 硝酸铜+二氧化氮+水3Cu+8HNO3=3Cu(NO3)2+2NO2↑+4H2O